Çiftlik hayvanlarının rasyonları ve beslenmesi optimize edilirken hayvan sağlığının iyileştirilmesine ve antibiyotik kullanımının azaltılmasına katkıda bulunan gastrointestinal işlevselliğin çeşitli yönleri de dikkate alınmalıdır (Allen ve ark., 2013; Cheng ve ark., 2014). Dolayısıyla, yem bileşenlerinin ve katkı maddelerinin gastrointestinal sağlıkla ilgili fonksiyonel özelliklerinin rasyon formülasyonunda daha temel bir rol oynaması gerekmektedir.

DSM Animal Nutrition
Bağırsak sağlığı hayvan beslemede giderek daha önemli ve popüler bir konu olsa da, net bir bilimsel tanıma hala sahip değildir (Kogut ve Arsenault, 2016). Herhangi bir besinsel müdahalenin hayvan sağlığı ve performansı üzerindeki etkilerini değerlendirmek için bir tanıma ihtiyaç vardır.
GASTROİNTESTİNAL İŞLEVSELLİK
Bizler, gastrointestinal işlevsellik için “mikrobiyom ve bağırsak sisteminin simbiyotik bir denge içinde bulunduğu; hayvanın refah ve performansının bağırsak işlev bozukluğu tarafından kısıtlanmadığı sabit bir durum” tanımını önermekteyiz (Celi ve ark., 2017).
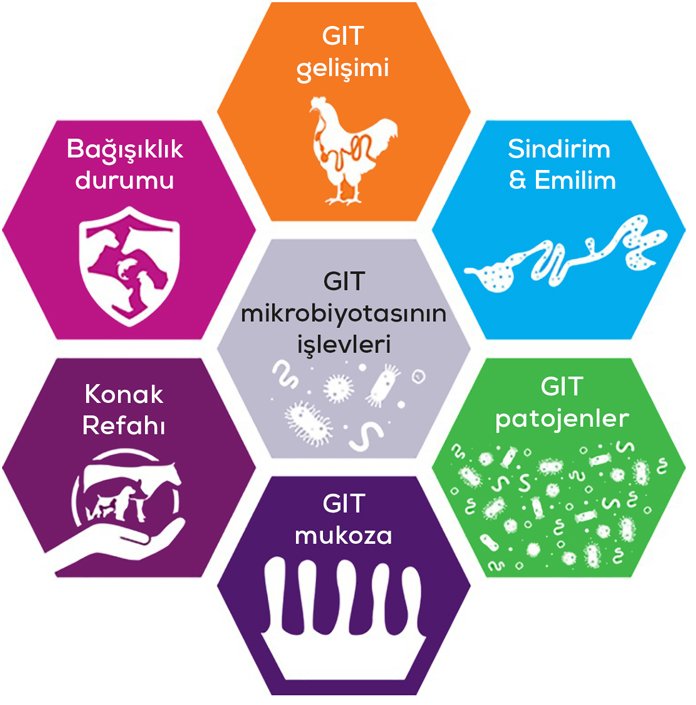
Bu tanım, gastrointestinal işlevselliğin temel bileşenlerini, yani rasyon, gastrointestinal bariyerin etkili yapısı ve işlevi ile normal ve stabil mikrobiyotayı yemin etkili sindirimi, emilimi ve güçlü bağışıklık durumu ile birleştirir (Şekil 1). Tüm bu bileşenler gastrointestinal fizyoloji, hayvan sağlığı, refahı ve performansında kritik bir rol oynamaktadır. Bağırsak sağlığının net bir şekilde anlaşılması, bu bileşenler arasındaki etkileşimlerin karakterize edilmesini gerektirecektir.
RASYON
Tüketilen besinler gastrointestinal sistemin (GIT) gelişiminde ve işlevselliğinde önemli bir rol oynayabildiğinden, rasyon içeriği (bileşenler, besinler ve katkı maddeleri) bağışıklık sistemi ve mikrobiyota da dahil olmak üzere sindirim sisteminin gelişimini ve işlevselliğini etkileyebilir (Conway, 1994).
Çok sayıda araştırma, sağlık ve refahı korurken hayvanların üretim performanslarının da sürdürülmesi için yem takviyelerinin, fonksiyonel gıdaların ve bileşenlerin kullanılmasının potansiyelini vurgulamaktadır (Van Loo, 2007; Pluske, 2013; Starkey, 2014; Hoste ve ark., 2015). Dahası, fonksiyonel bileşenlerin kullanımının bağışıklık sistemini desteklediği, redoks dengesini ve enflamatuar yanıtını düzenlediği görülmüştür. Çiftlik hayvanlarının rasyonları ve beslenmesi optimize edilirken, hayvan sağlığının iyileştirilmesine ve antibiyotik kullanımının azaltılmasına katkıda bulunan gastrointestinal işlevselliğin çeşitli yönleri de dikkate alınmalıdır (Allen ve ark., 2013; Cheng ve ark., 2014). Dolayısıyla, yem bileşenlerinin ve katkı maddelerinin gastrointestinal sağlıkla ilgili fonksiyonel özelliklerinin rasyon formülasyonunda daha temel bir rol oynaması gerekmektedir.
ETKİLİ SİNDİRİM VE EMİLİM
İyileştirilmiş gastrointestinal işlevselliğe genellikle iyileştirilmiş sindirim ve emilim eşlik eder, ancak bunun GIT işlevselliğinde gözlemlenen iyileşmenin doğrudan bir nedeni mi yoksa sonucu mu olduğu sorusu sorulabilir (Khadem ve ark., 2016). Ayrıca, bağırsak iltihabının GIT işlevini olumsuz etkilediği de göz önünde bulundurulmalıdır. Gerçekten de, GIT’deki patojenlerin çoğalması, savunma reaksiyonlarının artmasına yol açabilir ve buna sindirim verimliliğinde azalma ve hem makro hem de mikro besin maddelerinin emiliminde azalma eşlik eder. Emilim bozukluğu en çok mikro besinler, özellikle de demir ve çinko için fark edilirken (Davin vd., 2012, 2013), makro besinler arasında en çok etkilenen yağdır (Koutsos vd., 2003, 2006). Emilim bozukluğu, GIT boyunca besinlerin geçiş hızının artmasına ve dolayısıyla besinlerin sindirilmesi ve emilmesi için mevcut sürenin azalmasına bağlanabilir. Emilim bozukluğu aynı zamanda GIT bariyerinin bütünlüğünü ve işlevini kaybetmesinin veya bağışıklık sistemi tarafından patojenlere karşı gösterilen doğrudan bir reaksiyonun sonucu da olabilir (Klasing, 2007).
GIT MİKROBİYOTASI
Bağırsak mikrobiyotası koruyucu, yapısal ve metabolik işlevler gibi çeşitli fizyolojik işlevlere katkıda bulunur (Salzman ve ark., 2007; Lee ve Hase, 2014; Marchesi ve ark., 2016; Round ve Mazmanian, 2009). İdeal sindirim ve emilime, enerji metabolizmasının düzenlenmesine, mukozal enfeksiyonların önlenmesine ve bağışıklık sisteminin modülasyonuna destek olan bağırsak mikrobiyotası, böylece konakçı homeostazının düzenlenmesinde rol oynar.
Sonuç olarak, GIT mikrobiyota bileşiminin besinlerle manipülasyonu, bağırsak sorunlarını önlemek ve hayvan performansını artırmak için cazip bir araçtır. Besinsel müdahaleler, konakçı ve GIT mikrobiyotası arasındaki dengeyi oluşturup koruyacak ve GIT’in yapısının ve işlevinin bozulmasını önleyecek GIT’teki koşulları destekleyecek şekilde tasarlanmalıdır.
Çiftlik hayvanlarında GIT mikrobiyotasının gelişimini etkileyen faktörler nelerdir? Hayvan beslemesi, GIT fizyolojisi, hayvan sağlığı ve refahı arasındaki ilişkilerde GIT mikrobiyotasının rolü nedir? Bu soruların kısa sürede yanıtlanması kolay olmamakla birlikte, bütünüyle ele alınabilmeleri için disiplinler arası bir sistemin benimsenmesi gerekmektedir. AGP’lere alternatiflerin geliştirilmesinde ihtiyaç duyulan yardımı sağlamak için bu soruların ele alınması zorunlu olacaktır. Bu yaklaşım, yeni ve mevcut ürünlerle rasyon müdahale stratejilerini mümkün kılmak için çok önemli olacaktır.
![]() GUT MUKOZA
GUT MUKOZA
GIT bariyeri, bağırsak epitel hücrelerinin tek tabakasını örten mukus tabakasından ve bağırsakla ilişkili lenfoid dokuyu (GALT) oluşturan mezenkimal hücreler, dendritik hücreler, lenfositler ve makrofajlardan oluşan temel bir dizi hücreden oluşur. Bağırsak epitel hücreleri (IEC), mukus tabakasının bileşimini salgılayıp düzenledikleri ve temeldeki hücrelerle etkileşime girdikleri için bu sistemin merkezinde yer alır.
GIT mukozal epiteli ve bununla ilişkili GALT, konakçıda besin alımındaki değişikliklere maruz kalan ilk bölgelerdir. Besinlerin GALT’nin gelişimini ve işlevini nasıl değiştirebileceği konusunda nispeten az şey bilinse de, rasyonun GALT’nin gelişimini modüle edebildiği gözlemlenmiştir.
Besin alımı ve mikrobiyota kolonizasyonu, GIT’nin gelişimine paralel olarak meydana gelen GALT gelişimini teşvik eder ve işlevsel bir bağışıklık sistemi ile sonuçlanır. GALT, patojenik olan ve olmayan antijenleri ve yem kaynaklı iplikleri konakçı için ayırt ederek gastrointestinal işlevselliği destekler. Bu homeostatik oryantasyon, fizyolojik etkinlikler ve GIT’deki bağışıklık tepkisinin düzensizleşmesine neden olabilen hızlandırılmış üretim performansları tarafından sürekli olarak zorlanır.
REFAH
Hayvanlar zorlu çevre koşulları (sıcaklık stresi), kötü hijyen, yüksek hayvan barındırma oranları gibi koşullarda veya yaşamlarının üretken dönemlerinin fizyolojik aşamalarında (gebelik ve laktasyon) zorlanmaktadırlar. Bu tür dönemlerde, besin takviyelerinin yalnızca hayvanların gereksinimlerini karşılamakla kalmaması, aynı zamanda GALT işlevini en üst düzeye çıkarması ve hayvanın refahının optimum düzeyde sürdürülmesine katkı sunması kritik bir öneme sahiptir. Fonksiyonel bileşenler, sağlığı ve refahı korurken hayvanın üretim performansını artırabilir. Optimal gastrointestinal işlevsellik hayvan sağlığı, performansı, refahı ve çevre için çok önemlidir çünkü yem verimliliğini artırır, antibiyotik kullanımını azaltır ve gıda güvenliğini sürdürür. Bu nedenle, gastrointestinal işlevselliğin iyileştirilmesi sürdürülebilir hayvansal üretimi teşvik edecektir.
ETKİLİ BAĞIŞIKLIK DURUMU
Yeterli miktarda temel besin maddesi sağlamayan bir rasyonla beslemenin hayvanın bağışıklığını tehlikeye atacağı açık olsa da, besinsel bağışıklık modülasyonu konusundaki bilgilerimizi ilerletmek için ele alınması gereken bazı önemli sorular vardır. Örneğin, belirli besinler mukozal bağışıklık sisteminin gelişimini nasıl modüle eder ve müdahale için kritik aralıklar nelerdir? Mikrobiyota ve konağın bağışıklık sistemi arasındaki ilişkiler nelerdir? Konakçı ve mikrobiyotanın bir ‘süper organizma’ oluşturduğu ve “bağışıklık sisteminin bir katil değil, süper organizmada homeostazı şekillendiren bir güç olduğu” öne sürülmüştür (Eberl, 2010). Homeostazın sağlanması ve sürdürülmesi birçok faktöre bağlıdır ve bu da bağırsak fizyolojisi, endokrinoloji, mikrobiyoloji, immünoloji ve beslenmeyi birleştiren multidisipliner bağırsak sağlığı tanımımıza daha fazla destek sağlamaktadır.
Bize göre, gastrointestinal işlevselliği optimize etmek için besinsel müdahalelerle bağlantılı çeşitli GIT koşullarının değerlendirilmesinde ve ilerleyişinde daha iyi bir anlayış; bu tür bilgileri hayvan bilimcileri ve yem formülatörleri için pratik uygulamalara dönüştürmek ve sonuçta hayvanlara daha fazla sağlık ve refah sağlamak için bilimsel topluluklar tarafından bir öncelik haline getirilmelidir.
Referanslar
1. Allen, H.K., Levine, U.Y., Looft, T., Bandrick, M., Casey, T.A., 2013. Treatment, promotion, commotion: antibiotic alternatives in food-producing animals. Trends Microbiol. 21, 114-119.
2. Celi, P. Cowieson, A.J., Fru-Nji, F., Steinert, R.E., Kluenter, A-M., Verlhac, V. 2017. Gastrointestinal functionality in animal nutrition and health: New opportunities for sustainable animal production. Animal Feed Science and Technology 234: 88-100.
3. Cheng, G., Hao, H., Xie, S., Wang, X., Dai, M., Huang, L., Yuan, Z., 2014. Antibiotic alternatives: the substitution of antibiotics in animal husbandry? Front. Microbiol. 5, 217.
4. Conway, P.L., 1994. Function and regulation of the gastrointestinal microbiota of the pig, In: Souffrant, W.B., Hagemeister, H. ((Ed.), Proceedings of the VIth International Symposium on Digestive Physiology in Pigs, EAAP Publication, Dummerstof, pp. 231–240.
5. Davin, R., Manzanilla, E.G., Klasing, K.C., Perez, J.F., 2012. Evolution of zinc, iron, and copper concentrations along the gastrointestinal tract of piglets weaned with or without in-feed high doses of zinc oxide compared to unweaned littermates. J. Anim. Sc.i 90 Suppl 4, 248-250.
6. Davin, R., Manzanilla, E.G., Klasing, K.C., Perez, J.F., 2013. Effect of weaning and in-feed high doses of zinc oxide on zinc levels in different body compartments of piglets. J. Anim. Physiol. Anim. Nutr. 97 Suppl 1, 6-12.
7. Eberl, G., 2010. A new vision of immunity: homeostasis of the superorganism. Mucosal immunol. 3, 450-460.
8. Hoste, H., Torres-Acosta, J.F., Sandoval-Castro, C.A., Mueller-Harvey, I., Sotiraki, S., Louvandini, H., Thamsborg, S.M., Terrill, T.H., 2015. Tannin containing legumes as a model for nutraceuticals against digestive parasites in livestock. Vet. Parasitol. 212, 5-17.
9. Khadem, A., Lourenço, M., Delezie, E., Maertens, L., Goderis, A., Mombaerts, R., Höfte, M., Eeckhaut, V., Van Immerseel, F., Janssens, G.P.J., 2016. Does release of encapsulated nutrients have an important role in the efficacy of xylanase in broilers? Poult. Sci. 95, 1066-1076.
10. Klasing, K.C. 2007. Nutrition and the immune system. Br. Poult. Sci., 48 , 525-537
11. Kogut, M.H., Arsenault, R.J., 2016. Editorial: Gut Health: The New Paradigm in Food Animal Production. Front. Vet. Sci. 3.
12. Koutsos, E.A., Calvert, C.C., Klasing, K.C., 2003. The effect of an acute phase response on tissue carotenoid levels of growing chickens (Gallus gallus domesticus). Comp. Biochem. Physiol. A Mol. Integr. Physiol. 135, 635-646.
13. Koutsos, E.A., Garcia Lopez, J.C., Klasing, K.C., 2006. Carotenoids from in ovo or dietary sources blunt systemic indices of the inflammatory response in growing chicks (Gallus gallus domesticus). J. Nutr. 136, 1027-1031.
14. Lee, W.-J., Hase, K., 2014. Gut microbiota-generated metabolites in animal health and disease. Nat. Chem. Biol. 10, 416-424.
15. Marchesi, J.R., Adams, D.H., Fava, F., Hermes, G.D.A., Hirschfield, G.M., Hold, G., Quraishi, M.N., Kinross, J., Smidt, H., Tuohy, K.M., Thomas, L.V., Zoetendal, E.G., Hart, A., 2016. The gut microbiota and host health: a new clinical frontier. Gut. 65, 330-339.
16. Pluske, J.R., 2013. Feed- and feed additives-related aspects of gut health and development in weanling pigs. J. Anim. Sci. Biotechnol. 4, 1.
17. Round, J.L., Mazmanian, S.K., 2009. The gut microbiota shapes intestinal immune responses during health and disease. Nat. Rev. Immunol. 9.
18. Salzman, N.H., Underwood, M.A., Bevins, C.L., 2007. Paneth cells, defensins, and the commensal microbiota: A hypothesis on intimate interplay at the intestinal mucosa. Semin. Immunol. 19, 70-83.
19. Starkey, J.D., 2014. Triennial Growth Symposium–A role for vitamin D in skeletal muscle development and growth. J. Anim. Sci. 92, 887-892.
20. Van Loo, J., 2007. How chicory fructans contribute to zootechnical performance and well-being in livestock and companion animals. J. Nutr. 137, 2594s-2597s.